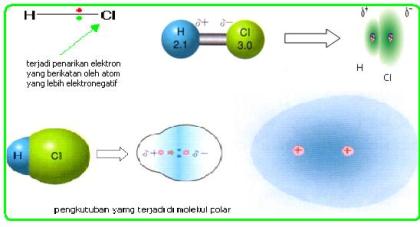
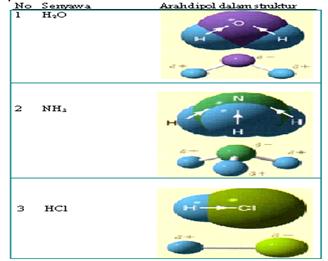
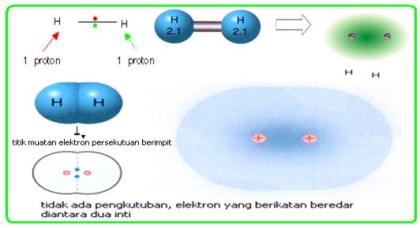
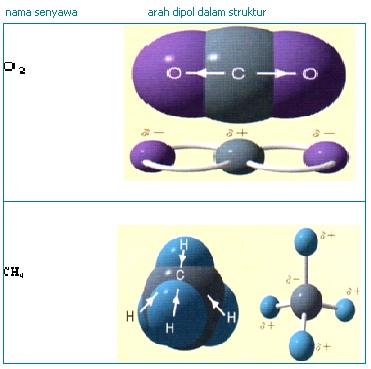
Secara umum persamaan reaksi kesetimbangan atau reaksi bolak-balik dapat dinyatakan :
aA + bB ? cC + dD dimana a, b, c, dan d adalah koefisien stokiometri dari A, B, C, dan D.
Tetapan kesetimbangan (K) untuk reaksi tersebut pada suhu tertentu dapat dinyatakan :

Lambang Q digunakan untuk nilai perbandingan konsentrasi (quosien konsentrasi) pada setiap keadaan. Nilai perbandingan konsentrasi Q, untuk reaksi kesetimbangan disebut “TETAPAN KESETIMBANGAN “dengan lambang K.
Dalam sistem pada kesetimbangan, dapat dinyatakan Q = K
Dalam sistem bukan kesetimbangan, dapat dinyatakan Q ? K
Jadi tetapan kesetimbangan untuk reaksi,


Besarnya tetapan kesetimbangan suatu reaksi pada temperatur tertentu hanya dapat ditentukan dengan data ekperimen dan tidak dapat diramalkan dari persamaan reaksi. Keteraturan yang diperoleh dari data eksperimen tentang sistem kesetimbangan dikenal dengan “hukum kesetimbangan”. Ada dua cara, yaitu pertama menggunakan energi bebas standar reaksi dan kedua dengan pengukuran langsung konsentrasi kesetimbangan yang dapat disubstitusikan ke dalam ungkapan aksi massa. Komposisi kesetimbangan dapat berubah bergantung pada kondisi reaksi. Akan tetapi, pada tahun 1864 Cato Maximillian Gulberg dan Peter Wage menemukan adanya suatu hubungan yang tetap antara
konsentrasi komponen dalam kesetimbangan. Hubungan yang tetap ini disebut Hukum Kesetimbangan atau Hukum Aksi Massa. Harga tetapan kesetimbangan sangat berguna baik secara kuantitatif maupun kualitatif. Secara kuantitatif, memungkinkan untuk
digunakan untuk menghitung konsentrasi pereaksi dan atau hasil reaksi dalam sistem kesetimbangan, sedang secara kualitatif, dapat memberikan informasi tentang sejauh mana reaksi berlangsung kearah reaksi sempurna.

Tetapan kesetimbangan berubah jika temperatur berubah. Pada temperatur tertentu, mungkin terdapat banyak campuran reaksi, setiap reaksi mempunyai konsentrasi pereaksi yang berbeda dalam keadaan kesetimbangan.

Suatu reaksi dapat dinyatakan lebih dari satu persamaan, besarnya tetapan kesetimbangan bergantung pada persamaan reaksi. Dengan demikian persamaan reaksi harus diketahui untuk menyatakan tetapan kesetimbangan.
Misalnya,

Secara garis besar umum tentang tetapan kesetimbangan dapat diungkapkan bahwa:
“Jika harga K besar, berarti kedudukan kesetimbangan jauh di sebelah kanan, sebaliknya jika harga K kecil berarti hanya sejumlah kecil hasil reaksi yang ada dalam kesetimbangan“.

Apakah arti ungkapan tetapan kesetimbangan ini ?


Jika K=1 maka kesetimbangan akan bergeser kearah kanan membentuk produk. Sebaliknya jika K=1 maka kesetimbangan akan bergeser kekiri membentuk reaktan.
Makna tetapan kesetimbangan bagi suatu reaksi antara lain :


2. Meramalkan arah reaksi
Apabila zat pada ruas kiri dan ruas kanan dari suatu reaksi kesetimbangan dicampurkan dalam suatu wadah reaksi maka sangat mungkin bahwa campuran tidak setimbang. Reaksi harus berlangsung ke kanan atau ke kiri sampai mencapai kesetimbangan.
aA + bB ? cC + dD dimana a, b, c, dan d adalah koefisien stokiometri dari A, B, C, dan D.
Tetapan kesetimbangan (K) untuk reaksi tersebut pada suhu tertentu dapat dinyatakan :

Lambang Q digunakan untuk nilai perbandingan konsentrasi (quosien konsentrasi) pada setiap keadaan. Nilai perbandingan konsentrasi Q, untuk reaksi kesetimbangan disebut “TETAPAN KESETIMBANGAN “dengan lambang K.
Dalam sistem pada kesetimbangan, dapat dinyatakan Q = K
Dalam sistem bukan kesetimbangan, dapat dinyatakan Q ? K
Jadi tetapan kesetimbangan untuk reaksi,
Besarnya tetapan kesetimbangan suatu reaksi pada temperatur tertentu hanya dapat ditentukan dengan data ekperimen dan tidak dapat diramalkan dari persamaan reaksi. Keteraturan yang diperoleh dari data eksperimen tentang sistem kesetimbangan dikenal dengan “hukum kesetimbangan”. Ada dua cara, yaitu pertama menggunakan energi bebas standar reaksi dan kedua dengan pengukuran langsung konsentrasi kesetimbangan yang dapat disubstitusikan ke dalam ungkapan aksi massa. Komposisi kesetimbangan dapat berubah bergantung pada kondisi reaksi. Akan tetapi, pada tahun 1864 Cato Maximillian Gulberg dan Peter Wage menemukan adanya suatu hubungan yang tetap antara
konsentrasi komponen dalam kesetimbangan. Hubungan yang tetap ini disebut Hukum Kesetimbangan atau Hukum Aksi Massa. Harga tetapan kesetimbangan sangat berguna baik secara kuantitatif maupun kualitatif. Secara kuantitatif, memungkinkan untuk
digunakan untuk menghitung konsentrasi pereaksi dan atau hasil reaksi dalam sistem kesetimbangan, sedang secara kualitatif, dapat memberikan informasi tentang sejauh mana reaksi berlangsung kearah reaksi sempurna.

Tetapan kesetimbangan berubah jika temperatur berubah. Pada temperatur tertentu, mungkin terdapat banyak campuran reaksi, setiap reaksi mempunyai konsentrasi pereaksi yang berbeda dalam keadaan kesetimbangan.

Suatu reaksi dapat dinyatakan lebih dari satu persamaan, besarnya tetapan kesetimbangan bergantung pada persamaan reaksi. Dengan demikian persamaan reaksi harus diketahui untuk menyatakan tetapan kesetimbangan.
Misalnya,
Secara garis besar umum tentang tetapan kesetimbangan dapat diungkapkan bahwa:
“Jika harga K besar, berarti kedudukan kesetimbangan jauh di sebelah kanan, sebaliknya jika harga K kecil berarti hanya sejumlah kecil hasil reaksi yang ada dalam kesetimbangan“.

Apakah arti ungkapan tetapan kesetimbangan ini ?


Jika K=1 maka kesetimbangan akan bergeser kearah kanan membentuk produk. Sebaliknya jika K=1 maka kesetimbangan akan bergeser kekiri membentuk reaktan.
Makna tetapan kesetimbangan bagi suatu reaksi antara lain :


2. Meramalkan arah reaksi
Apabila zat pada ruas kiri dan ruas kanan dari suatu reaksi kesetimbangan dicampurkan dalam suatu wadah reaksi maka sangat mungkin bahwa campuran tidak setimbang. Reaksi harus berlangsung ke kanan atau ke kiri sampai mencapai kesetimbangan.